|
|
1. O QUE É TEMPERATURA? Suponha que você tenha dois objetos em temperaturas
diferentes. Pode ser que seja possível avaliar qual está
numa temperatura mais elevada utilizando o tato. Essa seria uma
avaliação qualitativa do problema. O termômetro indica a variação de temperatura do sistema.
|
|
2. O QUE É CALOR? Calor é uma forma de energia em trânsito. Ela aparece quando existe uma diferença de temperatura entre dois corpos. Portanto, o calor é medido nas unidades usuais de energia, como o Joule (J) ou caloria (cal) e os seus múltiplos. 1 cal = 4,186 J (1) 3. MUDANÇAS DE FASE As substâncias apresentam-se na natureza
em diferentes estados
físicos. Podemos considerar como os estados mais
comuns na natureza: sólido, líquido e gasoso. Em estudos
mais avançados da Física, são também
estudados o plasma
e o condensado
de Bose-Einstein.
Figura 1: O diagrama mostra a nomenclatura utilizada
para definir as transições entre as fases sólida,
líquida e gasosa das substâncias. 4. CAPACIDADE TÉRMICA Suponha que estamos fornecendo a mesma quantidade
de calor a dois corpos, compostos por substâncias diferentes.
Depois de um certo tempo, cada um apresentará um incremento
de temperatura diferenciado. Essa situação evidencia
que diferentes substâncias possuem diferentes comportamentos
térmicos. Mesmo que os corpos sejam feitos de um mesmo material,
eles podem ter capacidades térmicas diferentes, desde que
suas massas sejam diferentes. C = DQ / Dt (2) Podemos observar pela relação que quanto maior for
a capacidade térmica do corpo, maior deverá ser a
quantidade de calor a ser fornecida para provocar uma determinada
elevação de temperatura da substância. 5. CALOR ESPECÍFICO
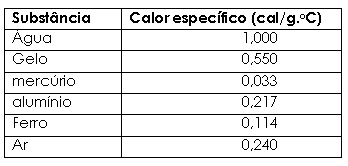
Já vimos que a capacidade térmica varia de uma substância para outra. Mas quando trabalhamos com um mesmo material as capacidades térmicas podem ser diferentes se cada conjunto tiver uma massa diferente. Entretanto, o quociente C/m é constante para cada material e é esse valor que denominamos de calor específico. c = C / m (3) Portanto, o calor específico é uma
característica absoluta de cada substância.
Para massas de água, que tem calor específico relativamente alto, observamos a ocorrência de diversos fenômenos relacionados ao clima. Mares, lagos e rios, que concentram grande quantidade de água, acabam regulando a temperatura nas suas regiões de entorno. Durante o dia, a água absorve grande quantidade de calor, mas aquece-se pouco. Quando anoitece, ela libera calor para o entorno, esfriando devagar. Uma consequência disso é que locais próximos aos mares e lagos tendem a ter pequena amplitude térmica (diferença entre a temperatura máxima do dia e mínima da noite). Isso é verificado, por exemplo, nas cidades do litoral brasileiro. Também a direção das brisas costeiras é definida a partir da contribuição desse fenômeno. 6. CALOR SENSÍVEL
E CALOR LATENTE
O fornecimento ou a retirada de calor, como forma de energia para um corpo, resulta em dois fenômenos possíveis: variação na temperatura ou mudança de fase. Denominamos calor sensível a quantidade de calor recebida ou cedida para um corpo que resulta em variação da temperatura do mesmo, sem mudança de fase. Por exemplo, ao aquecermos água em uma panela de 30oC até 60oC, estamos lidando apenas com calor sensível, pois nesse intervalo de temperaturas, a água não muda de fase. Quando o corpo sofre apenas uma mudança de fase, denominamos o calor responsável por essa mudança de calor latente. Durante esse processo, a substância não varia de temperatura. No caso da água, nota-se experimentalmente que, para transformar uma massa de 1 grama de gelo a 0oC em água a 0oC, ou seja, completar a fusão do gelo, é necessário fornecer 80 cal. Da mesma forma, para transformar 1 grama de água a 100oC em vapor de água a 100oC, são precisos 540 calorias. Cada substância tem seus valores próprios nessas transições de fase. Para determinarmos o calor latente (L) de cada substância, podemos fazer: L = Q / m ® Q = m . L (4) Observe os valores de calor latente para a água:
Vamos tomar como exemplo o calor latente de fusão
do gelo, que é igual a 80 cal/g. Isso quer dizer que cada
grama de gelo (1 grama de gelo) necessita receber 80 calorias para
mudar seu estado físico, passando de gelo a 0oC
para água a 0oC. Essa é a lógica
que rege a indicação de valores para a tabela de calor
latente vista acima, e cada substância terá seus valores
específicos. Os valores de calor latente (do gelo e água)
e de calor específico da água (como já vimos)
são importantes para entendermos os fenômenos macro
e microclimáticos, uma vez que a água de oceanos,
rios, lagos e geleiras são fundamentais para a regulação
do
clima do planeta. Aumentos nas temperaturas médias
em determinadas regiões provocam, por exemplo, a fusão
do gelo dos polos e das geleiras, alterando o nível dos mares
e o equilíbrio do ecossistema (Figura 2).
Figura 2: O aquecimento global pode ser o principal fator que vem contribuindo para a diminuição de gelo nos polos e das geleiras.
7. EQUAÇÃO
FUNDAMENTAL DA CALORIMETRIA
Experimentalmente, mostra-se que a quantidade de calor fornecida a um corpo relaciona-se com a massa (m) e com a variação de temperatura sofrida pela substância (Dt = tfinal - tinicial), a menos de uma constante, que é o calor específico da substância (c). Q = m . c . Dt (5) Nas situações em que a temperatura final é maior do que a temperatura inicial, temos Q positivo, pois houve fornecimento de calor. Quando ocorre um resfriamento da substância, o sinal de Q será negativo. 8. CURVAS DE AQUECIMENTO E RESFRIAMENTO Podemos grafar o que ocorre com uma substância conforme ela recebe ou perde calor num diagrama de temperatura em função da quantidade de calor. Os patamares do gráfico correspondem às mudanças de fase, que envolvem calor latente. (Figura 3).
Figura 3: Curva de aquecimento
para uma substância genérica. 9. ENERGIA TÉRMICA
Entendemos o calor como sendo uma forma de energia. Ele pode ser transferido de um corpo para outro em situações em que existam diferenças de temperatura entre os corpos envolvidos. Portanto, o conceito moderno de calor pode ser compreendido como uma forma de energia em trânsito. Essa ideia de calor como energia foi introduzida pelo Conde Rumford (1753-1814), ao estudar o aquecimento de peças metálicas que eram perfuradas para produzir munição para canhões. Em 1798, ele elaborou a teoria que afirmava que a energia empregada no trabalho de perfuração era transferida para as peças, provocando o aumento de temperatura observado. A partir dos estudos de Rumford e a posterior consolidação da Termodinâmica como área de estudo e aplicação da Física, ficou definido que o grau de agitação molecular de um corpo define a quantidade de energia interna dele e, a partir daí, qualificamos o conceito de temperatura de um corpo ou sistema, diferenciando-o do conceito de calor(Figura 4).
Figura 4: T1 > T2: O corpo
de temperatura maior (T1) transfere calor para o corpo
de temperatura menor (T2).
10. POTÊNCIA
DE UMA FONTE DE CALOR
Como o calor é uma forma de energia, podemos dizer que as fontes de calor são corpos ou sistemas termodinâmicos (como o Sol) capazes de transferir calor para outros corpos ou sistemas. Partindo do princípio que o calor é uma forma de energia, então é possível definir também a potência térmica (P) de uma fonte de calor, que é dada por: P = Energia / tempo Usualmente, essa potência é expressa
em joules por segundo (J/s = watt = W), mas também podemos
utilizar outras unidades, como calorias por segundo (cal/s). Lâmpadas incandescentes, aquecedores e outros
objetos emitem calor para o meio e são fontes de calor significativas.
Note que também o corpo humano pode ser considerado uma fonte
de calor, pois nosso metabolismo mantém a temperatura do
corpo em 37oC. Por conta disso, usamos roupas leves e
claras em locais quentes e ensolarados e preferimos materiais isolantes
(como roupas e cobertores de lã) em dias mais frios, para
minimizar a perda de calor de nosso corpo para o meio externo. 11. PROCESSOS DE TRANSMISSÃO DE CALOR 11.1 Condução É o tipo de transmissão de calor
que ocorre por contato. Como no caso que vemos na animação,
o calor da chama aquece a extremidade esquerda da barrinha metálica,
fazendo com que os átomos ou moléculas do metal nessa
extremidade tenham maior grau de agitação. Uma parte
dessa energia é transferida por contato para moléculas
vizinhas, fazendo com que o calor se propague em direção
à extremidade direita e chegue até a mão da
pessoa, que sente um progressivo aumento de temperatura no local
em que está segurando.
11.3 Irradiação
Figura 6: O Sol é uma estrela que produz energia a partir de reações termonucleares. Com isso, é capaz de fornecer energia para o nosso sistema solar e para o planeta Terra, incluindo a energia térmica (calor) que sustenta a vida.
A constante solar representa a potência do
Sol por unidade de área diretamente exposta à luz
solar. A constante solar é igual a, aproximadamente, 1368
W/m2.
12. APLICAÇÕES
TECNOLÓGICAS
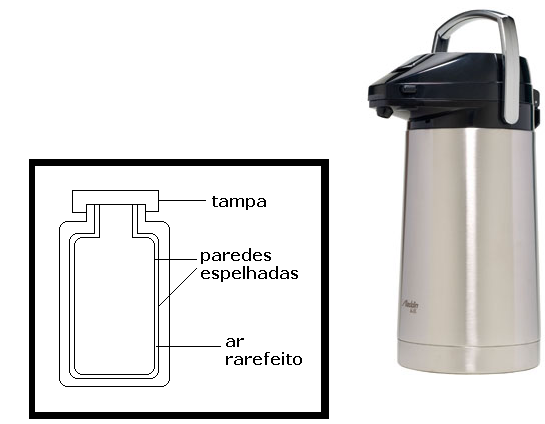
As aplicações dos estudos da propagação do calor são muitas e vão da construção de utensílios ao projeto de máquinas diversas, aviões, motores e estudos aplicados, como os da meteorologia. Entre essas aplicações tecnológicas, vale citar uma que conhecemos em nosso dia a dia: a garrafa térmica. O recipiente tem o objetivo de minimizar as trocas térmicas entre o líquido e o meio externo. Assim, podemos manter tanto um café quente como um suco gelado preservado por mais tempo. Isso é obtido dificultando os três tipos de transmissão de calor. A ampola é feita com duas paredes espelhadas de vidro com ar rarefeito entre elas. Isso retarda o processo de irradiação e evita a condução e a convecção. A ampola é protegida por um invólucro exterior, que pode ser de metal ou plástico. Essas paredes também são espelhadas tanto no lado de fora quanto no de dentro. O conjunto é completado com uma tampa de pressão ou rosca que veda a parte superior do recipiente (Figura 8).
Figura 8: Garrafa térmica.
Também podemos observar a aplicação
destes estudos na engenharia. Na construção de casas,
por exemplo, os materiais escolhidos devem estar de acordo com o
que se quer obter. Nos telhados, o uso de materiais isolantes térmicos
pode auxiliar a reter o calor no interior da casa (em regiões
frias) ou a refletir parte da luz incidente (com o uso de tons claros
no telhado e na pintura externa) para evitar aquecimento indesejável
(em regiões tropicais). |